Ernest Rutherford, también conocido como Lord Rutherford, fue un físico y químico neozelandés dedicado al estudio de las partículas radioactivas, y a quien se le acredita el descubrimiento del núcleo central del átomo, que cambio para siempre el curso de la investigación de la física.

Biografía de Ernest Rutherford
Ernest Rutherford nació el 30 de agosto de 1871, en la ciudad de Nelson, en el estado de Nueva Zelanda; siendo hijo de James Rutherford, un granjero y mecánico de origen escocés, y de Martha Rutherford, una maestra de origen inglés que emigró antes de casarse, provenía de una familia humilde y sencilla.
Como en cada hogar del mundo, su familia aspiraba el éxito de sus descendientes dentro de los ambitos academicos de la sociedad del siglo XIX; de esta forma, este futuro científico creció siendo un ciudadano común, logrando culminar sus estudios académicos para el año de 1893, con la obtención de su primera licenciatura en Christchurch (Nueva Zelanda).
2 años más tarde, en la biografía de Rutherford indica la gran oportunidad de ingresar a la Universidad de Cambridge, la cual le permitió continuar con sus estudios en Gran Bretaña, en los Laboratorios Cavendish de Cambridge, bajo la dirección del descubridor del electrón, J. J. Thomson, quien posteriormente se convertiría en su predecesor.
Posteriormente, para el año de 1898, luego de cumplir un periodo de 3 años en Cambridge, Ernest Rutherford recibió una oferta de trabajo para ejercer labores en la Universidad McGill de Montreal; la cual termino aceptando conmucha gratitud, convirtiéndose en uno de los pocos jóvenes, en adquirir un puesto de trabajo dentro de una de las más reconocidas entidades académicas en el campo de la física.

Más adelante, en el año 1902, tras haber contraído matrimonio con su prometida Mary Newton, y haber experimentado el nacimiento de su única hija Eileen; Ernest Rutherford decido reincorporarse en la búsqueda de nuevos descubrimiento para la química. Esto lo llevo a plantear la teoría sobre la radioactividad natural asociada a las transformaciones espontáneas de los elementos, con el apoyo del científico Frederick Soddy.
Así mismo, colaboró con Hans Geiger en el desarrollo del contador de radiaciones conocido como contador Geiger; poco después, en el año 1908, luego de un arduo proceso de investigación interactiva con partículas radioactivas, demostró que estas poseían propiedades significativas, las cuales se mencionaran mas adelante.
He de mencionar que los experimentos permitieron el establecimiento de un orden de magnitud para las dimensiones reales del núcleo atómico, además de establecer que la transmutación artificial de elementos químicos se debe a la capacidad de un átomo, de cambiar su estructura, al ser sometido a un bombardeo de partículas capaces de penetrar en su núcleo.
Su éxito se debía en gran parte a su creativa imaginación, que le permitía ver más allá de lo obvio, sin prestar atención a las posibles consecuencias teóricas más cercanas, ya que simplemente no podía tolerar que los grandes recursos de la humanidad fueran implementados de manera inconsciente.
Entre otras de sus grandes investigaciones, Ernest Rutherford logro demostrar que la emisión de energía térmica debido a la desintegración nuclear, era entre 20.000 y 100.000 veces superior al producido por una reacción química.
Así mismo, planteo la hipótesis de que tal energía podría explicar la energía desprendida por el sol, debido a que, en su opinión: «la tierra conserva una temperatura constante». Este representaría un gran avance en la exploración del potencial terrestre, para los tiempos en que Albert Einstein descubra la equivalencia entre masa y energía.
No obstante, muchos de estos proyectos de Ernest Rutherford aportes a la física fueron rechazados debido a que, en su mayoría, los científicos más reconocidos promulgaban que la simple idea de implementar los avances de la física y química en conflictos bélicos de esa magnitud, era un total desperdicio.
Cabe destacar que para ese entonces, la tecnología no había realizado muchos avances en beneficio de la población, algo tan sencillo como apreciar una fotografía tomada desde el cielo, era considerado un increíble invento de última generación; pero, durante la Primera Guerra Mundial, cuando todo cambio gradualmente.

A pesar de que los avances de la química, y los de la técnica, se mantenían separados por ideales distintos, se logró combinar ambos contextos para generar grandes proyectos de última generación, que promovió el crecimiento y la productividad de la ciencia y la tecnología en las últimas décadas del siglo XIX y principios del XX.
A partir de esto, la guerra alcanzó un punto de mayor altitud, gracias he que se estimaba implementar elementos de carácter mecánico, mas no de origen sintético, en el equipamiento de los recursos tácticos.
Esto conllevo al desarrollo de la ingeniería y permito el paso a una nueva generación de armas, pero también a la creación de ambulancias; y la medicina se valió, por primera vez, de la enfermería profesional en el frente.
A continuación verán una breve interpretación de la historia de vida de este gran científico:
Modelo atómico
A principios del siglo XX, los avances en la investigación científica sobre el entendimiento de la materia como un elemento, habían concluido que esta era un componente, ni destructible, ni sintetizable, pero con capacidad de transformarse; del mismo modo, se establecido que las cargas eléctricas contenidas en los cuerpos microscópicos conocidos como “átomos” tenían una distribución aparentemente uniforme.
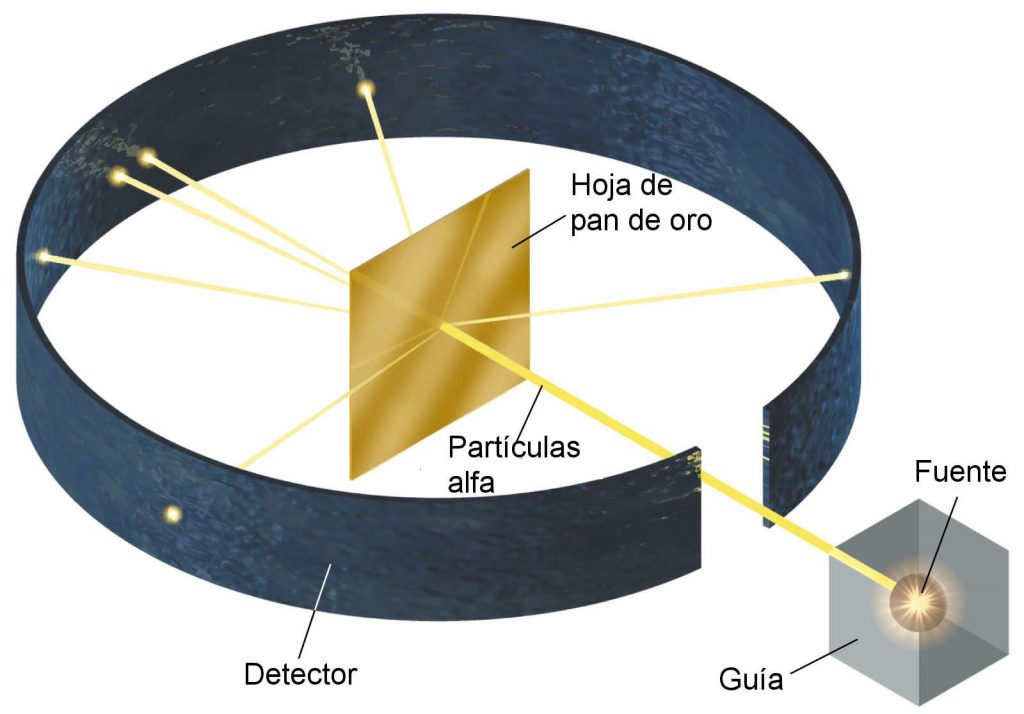
Sin embargo, como se dijo en la biografía de Ernest Rutherford, tenía una opinión distinta, ya que sus investigaciones en el campo de la química, lo habían conducido a sospechar que la estructura del átomo presentaba aspectos contrarios a los ya establecidos por sus predecesores; y por esta razón decidió comprobarlo.
Este experimento se basaba en los criterios establecidos en el modelo atómico de Thompson, el cual se consideraba que era el más cercano a la realidad en esa época; no obstante el resultado fue otro.

Luego de una minuciosa recopilación de datos, vio que la mayoría de las partículas cargadas negativamente, habían sufrido una leve desviación en un ángulo de 180, provocando que estas rebotaran en dirección opuesta a su trayectoria inicial.
A partir de este acontecimiento, se planteó la teoría de que la suma de las cargas eléctricas negativas de los electrones, debe ser igual a la carga positiva del núcleo, ya que el átomo es eléctricamente neutro.
Esto confirmó a Rutherford que los átomos de la lámina debían ser estructuras básicamente vacías, que poseían órbitas o espacios donde se concentraban la mayoría de las cargas y por los cuales se desplazaban los electrones, dándole un tamaño y forma algo indefinidas.
En el siguiente vídeo se describe a mayor profundidad, de como Lord Rutherford logro este gran descubrimiento de la ciencia del siglo XX:
Aportes significativos a la humanidad
Es considerado como el padre de la física nuclear por sus descubrimientos en el campo de la física atómica; obteniendo el premio Noble de la química, en el año de 1908, por sus investigaciones experimentales, y el desarrollo de la teoría nuclear de la estructura del átomo.
Del mismo modo, realizó la primera reacción nuclear artificial en el año 1919, y así entre otras de sus acciones, se convirtió en un de los personajes que cuyo trabajos tuvieron una enorme importancia en diversos campos de las ciencias naturales.
Aportaciones a la química
Entre sus contribuciones al desarrollo de la sociedad humana, a través del campo de la química, se encuentran los siguientes hechos:
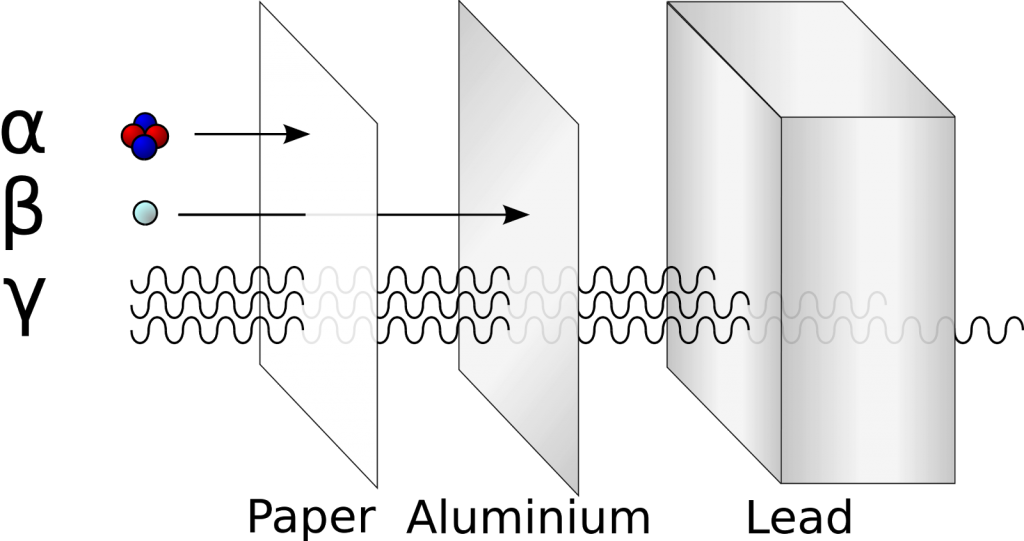
- Descubrió la radioactividad alfa y beta; Por medio de sus estudios sobre la radiación emitida por el uranio, y sus diversas experimentaciones con elementos radioactivos, concluyo que estos debían poseer al menos dos componentes.
- Comprobó la existencia de un tercer rayo; Debido a distintas interacciones con los ya descubiertos rayos alfa y beta. Rutherford comprendió que los rayos beta presentaban una mayor capacidad de penetración que sobrepasaba a los límites de la magnitud de los rayos alfas; de esta forma concluyo que se presentaba una interacción de magnitudes distintas, y decido renombrarla como rayos Gamma.
- Demostró que los átomos no eran indestructibles; En compañía del químico Frederick Soddy, desarrollo la teoría de la desintegración de los Átomos; que explica que átomo posee características no estables, que producen una eventual división de sus componentes en otros tipos de átomos.
- Formuló el primer modelo atómico más cercano a la realidad; Junto a los científicos Geiger y Mardsen, realizó uno de los experimentos más famosos de la ciencia, que anteriormente ha sido mencionado.
- Inventó un detector de ondas de radio; Rutherford interactuo con el efecto que tenían las ondas electromagnéticas en agujas de acero magnetizadas, basándose en los descubrimientos alcanzados por el físico alemán Heinrich Hertz en sus investigaciones.
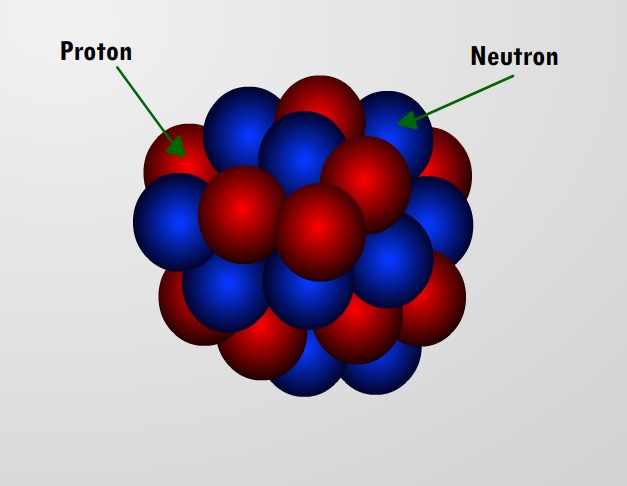
- Demostró la existencia del núcleo atómico; En su modelo atómico se observa que, este posee una característica particular, en la cual partículas alta cargadas electricamente, se concentran en un pequeño volumen del átomo, el cual es responsable por la mayoría de su masa.
- Descubrió el protón; Durante el año de 1917 se convirtió en la primera persona en transformar un elemento en otro, convirtiendo átomos de nitrógeno en átomos de oxígeno, al bombardearlos con partículas alfa, que provocaron que las partículas de nitrógeno sufrieran una mutación.
- Teorizó la existencia del neutrón; Para el año de 1921, los avances de su investigaciones lo llevaron a creer debía existir una partícula neutral en el núcleo del átomo para compensar el efecto de repulsión de los protones cargados positivamente; ya que de no ser así, el núcleo se desestabilizaría. No obstante, debido al limitado alcance de la tecnología de su tiempo, esta hipótesis no fue demostrada sino hasta el año de 1932, por el científico James Chadwick.
Para un mayor entendimiento, de los grandes beneficios que se han logrado a través de la ciencia, por favor vean el siguiente vídeo:
Descubrimientos
Ernest Rutherford es recordado por sus increíbles experimentos y por las grandes figuras de la física que estudiaron y trabajaron junto a el; no obstante, estos acontecimientos solo fueron una parte de su éxito, que lo convirtió en uno de los personajes de mayor influencia en el mundo, gracias a sus teorías.
- Descubrimiento de un núcleo denso y cargado positivamente
Este se convertiría en el primer hecho real sobre como estaba compuesta la estructura interna del átomo, pues han superando los criterios establecidos en el modelo atómico del científico J.J Thompson, que consideraba que la forma real del átomo era algo semejante a un «pudin de pasas»
En aquel tiempo, para el año de 1911, los avances en la investigación de la energía radioactiva, habían demostrado la existencia de característica singulares comprendidas dentro de los rayos X, las cuales se convirtieron en los ya conocidos rayos Alfa, Beta y Gamma.
Esto parecía indicar que la energía no se conservaba dentro de un mismo campo, y que esta era incapaz de comprimirse. No obstante, debido a la participación de diversos investigadores, entre ellos: se descubrió que la energía sí se conserva, gracias al descubrimiento de los neutrinos. (ver articulo: Enrico Fermi)
En el año 1906 publicó «El retraso de la partícula alfa del radio cuando atraviesa la materia», en Philosophical Magazine; un artículo que expresaba el proceso de la dispersión de las partículas alfa, a través de una superficie de aluminio.
Este hecho fue respaldado por el investigador Hans Geiger, quien realizo diversos experimentos con partículas alfa y ondas de radio, en los se apreciaban las diversas características que descubrió Rutherford. De esta forma, se reafirmo la nueva teoría del núcleo atómico.
- Descubrimiento del protón
En el año 1918, tras realizar un experimento que consistía en disparar partículas alfa contra un gas de nitrógeno, Ernest Rutherford percibió una raro cambio en sus detectores de centelleo, los cuales mostraban signos de núcleos de hidrógeno.

Cabe destacar que antes de él, otros investigadores también se enfocaron en la búsqueda de nuevos descubrimientos al experimentar con partículas de hidrógeno, tal es el caso de Eugene Goldstein, quien durante sus investigaciones observo rayos catódicos compuestos por iones cargados positivamente.
A partir de los fundamentos básicos del modelo atómico de Thompson, sugirió que, puesto que el átomo era eléctricamente neutro, el mismo debía contener partículas cargadas positivamente.
Sin embargo, a pesar de sus progresivos avances sus trabajos fueron largamente ignorados por la comunidad de físicos, quienes aun lidiaban con el entendimiento del comportamiento de las partículas alfa.
- Descubrimiento de las partículas alfa como núcleos de helio
Entre los años 1899 y 1900, los físicos Ernest Rutherford y Paul Villard habian catalogado los rayos de energía radioactiva en tres tipos (alfa, beta y gamma), a partir de esto, los inventos de Rutherford y Villard los llevaron a experimentos en los que atravesaban diversos grosores de hojas de papel con estos rayos, los cuales eventualmente terminaban en reacciones nucleares o la desintegración radiactiva de otros núcleos.
Sin embargo, se determino que su capacidad de penetración era mínima, ya que al estar expuestos a la atmósfera, disminuía gradualmente su energía cinética, por medio de su interacción con otras moléculas, generando una cantidad considerable de iones por centímetro de longitud recorrida.
Esto les permitió concluir que la dispersión de una partícula alfa por una fuerza de Coulomb repulsiva central, se desplaza en una trayectoria hiperbólica, que a través del ángulo de dispersión y del momento, se puede calcular el parámetro de impacto y la aproximación más cercana al núcleo objetivo.
- Descubrimiento de la radiactividad como una sustancia que disminuye con el tiempo
Poco después de que se descubrieran los rayos X, en 1895, el científico Antoine Henri Becquerel trató de demostrar la relación entre los rayos X y la fosforescencia de las sales de uranio. En uno de sus experimentos envolvió una placa fotográfica en papel negro, colocó una muestra de sal de uranio sobre ella y la expuso a la luz solar. Al revelar la placa apareció que los rayos emitidos por la sal habían penetrado a través del papel.
Por su parte, Ernest Rutherford, en el año 1899, comenzó a investigar la naturaleza de los rayos emitidos por el uranio, y pronto se dio cuenta que el uranio, emitía rayos alfa y beta, lo cual permitía que este se transformara en otro elemento. De acuerdo con la descripción del átomo nuclear, Rutherford atribuyó el fenómeno de la radiactividad, a reacciones que se efectúan en los núcleos de los átomos. (ver articulo: María Curie)
En el siguiente vídeo, verán un detallado resumen sobre el mundo de la física nuclear, comprendida desde el descubrimiento de la radiactividad hasta el modelo atómico de Rutherford:
Teoría de Ernest Rutherford
A medida en que los científicos fueron conociendo la estructura del átomo a través de experimentos, modificaron su modelo atómico para ajustarlos a los datos experimentales; entre ellos se destaca Ernest Rutherfor.
¿Qué descubrió Rutherford? Fue quien descubrió que la carga positiva del átomo está concentrada en su núcleo, y dedujo que el átomo debía estar formado por una corteza con los electrones girando alrededor de un núcleo central cargado positivamente; algo semejante al sistema de atracción gravitacional que compone el sistema solar.
Uno de los fundamentos que respalda la teoría es que la dispersión de partículas alfa de los núcleos, se puede modelar a partir de la fuerza de Coulomb y tratarla como una órbita.
De igual forma, el proceso de dispersión puede ser tratado estadísticamente en términos de la sección transversal para la interacción, con un núcleo que se considera como una carga puntual.

Así mismo, gracias a los inventos de Ernest Rutherford, muchos investigadores propusieron otras teorías que se fundamentaban el mismo hecho, pero que concluían en otros resultados; por ejemplo está el caso del físico danés Niels Bohr, quien propuso un nuevo modelo atómico, según el cual los electrones giran alrededor del núcleo en unos niveles u orbitas bien definida.
Posteriormente, su colega austriaco Edwin Schödinger descubrió que, de hecho, los electrones de un átomo se comportan más como ondas que como partículas. De esta forma, con el paso del tiempo, fueron establecidas nuevas y diversas teorías que poco a poco fueron alternando los criterios establecidos en el modelo original de Thomson, el cual presentaba un átomo estático y macizo.
La estructura atómica
Primeramente se debe entender que la estructura atómica es la manera en que está distribuida cada una de las partículas que forman a un átomo. Dichas partículas conocidas como protones y neutrones, se mantienen parcialmente unidas en un centro, dando la forma particular de un elemento neutro.
Hay que señalar que no todos los átomos de un elemento tienen la misma masa, ya que la mayoría de ellos poseen características y composiciones distintas, que les permiten cambiar o combinar lo estructura original con otros elementos. Dichas características puede ser ubicadas dentro de la conocida tabla periódica.

En esta, la mayoría de los elementos tienen 2 ó más átomos que tienen el mismo número atómico, pero diferente número másico. Por lo tanto la diferencia entre dos átomos o isótopos de un elemento dado, es el número de neutrones en el núcleo.
El átomo tiene en el medio un núcleo pequeño, con carga eléctrica positiva, siendo el contenedor de la mayoria de la masa del átomo. En este, los electrones dan vueltas mientras recorren grandes distancias alrededor del núcleo en órbitas circulares.
En conclusión, la representación de un sistema de partículas detallado, se debe considerar la naturaleza cuántica de las partículas y las propiedades de simetría de la función de onda de un sistema de partículas, para determinar sus respectivas estadísticas. (ver articulo: ¿Qué invento Albert Einstein?)
Como complemento de esta información, podrán ver el conceptualismo de los elementos más mencionados en esta redacción a través del siguiente vídeo:
Frases
Solo como complemento de esta información, aquí les presento un listado que abarca las frases más celebres del reconocido Lord Rutherford:
- “Un presunto descubrimiento científico no tiene ningún mérito, a menos que pueda ser explicado a una camarera”
- “Si tu experimento necesita estadística, hubiera sido necesario hacer un experimento mejor”
- “Toda la ciencia es física o filatelia”
- “Otras variantes sin fuentes:”
- “La radiactividad se muestra acompañada de cambios químicos en el que se producen continuamente nuevos tipos de materia…. Se concluye que estos cambios químicos deben poseer un carácter sub-atómico”

